چگونه ماده زنده با وجود شکست تقارن کنش-واکنش خودسازماندهی میکند؟
عنوان سخنرانی: چگونه ماده زنده با وجود شکست تقارن کنش-واکنش خودسازماندهی میکند؟
راههای زیادی برای مطالعهٔ زندگی وجود دارد. یکی از راههایی که بهویژه برای فیزیکدانها جذاب است، نگریستن به زندگی به عنوان مادهٔ نرمِ فعالِ خودسازمانیافته است که به بیان درست، از تعادل به دور است. در این کنفرانس، من دربارهٔ همین مفهوم بحث خواهم کرد و مثالهایی دربارهٔ این موضوع بیان میکنم که چهطور میتوانیم سیستمهای سادهای را کنارهم قرار دهیم که از مواد اولیهٔ کاملا درکپذیرساخته شدهاند. این امر یک نوع رفتار فعال را نشان میدهد که آن را در سیستمهای زنده مییابیم.
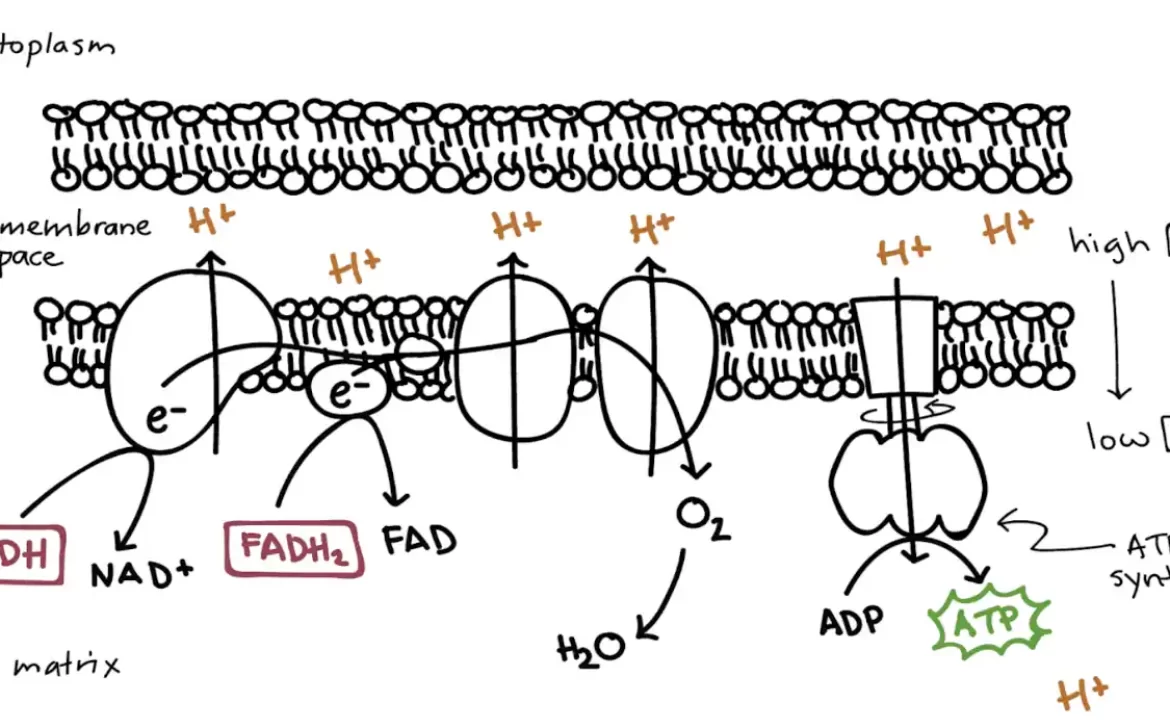
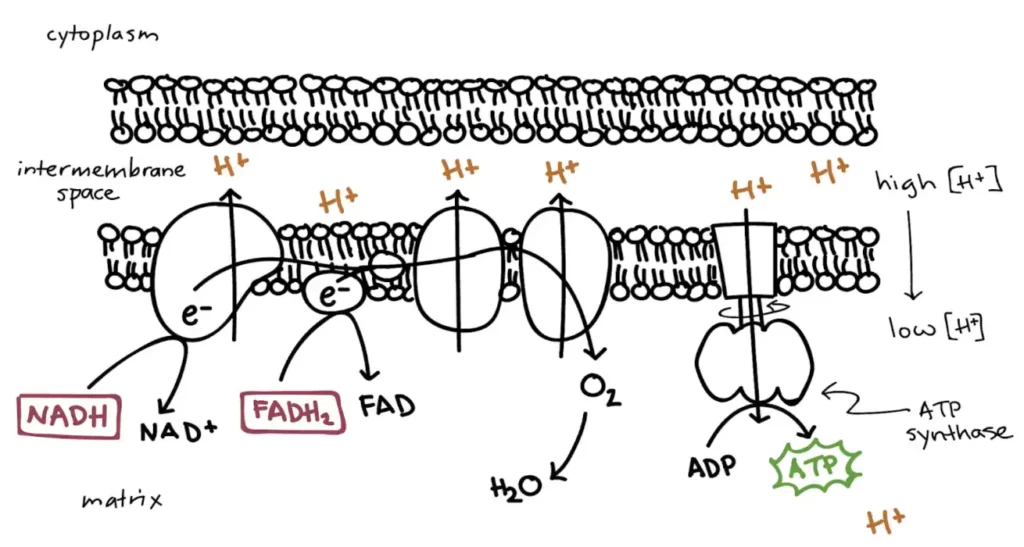
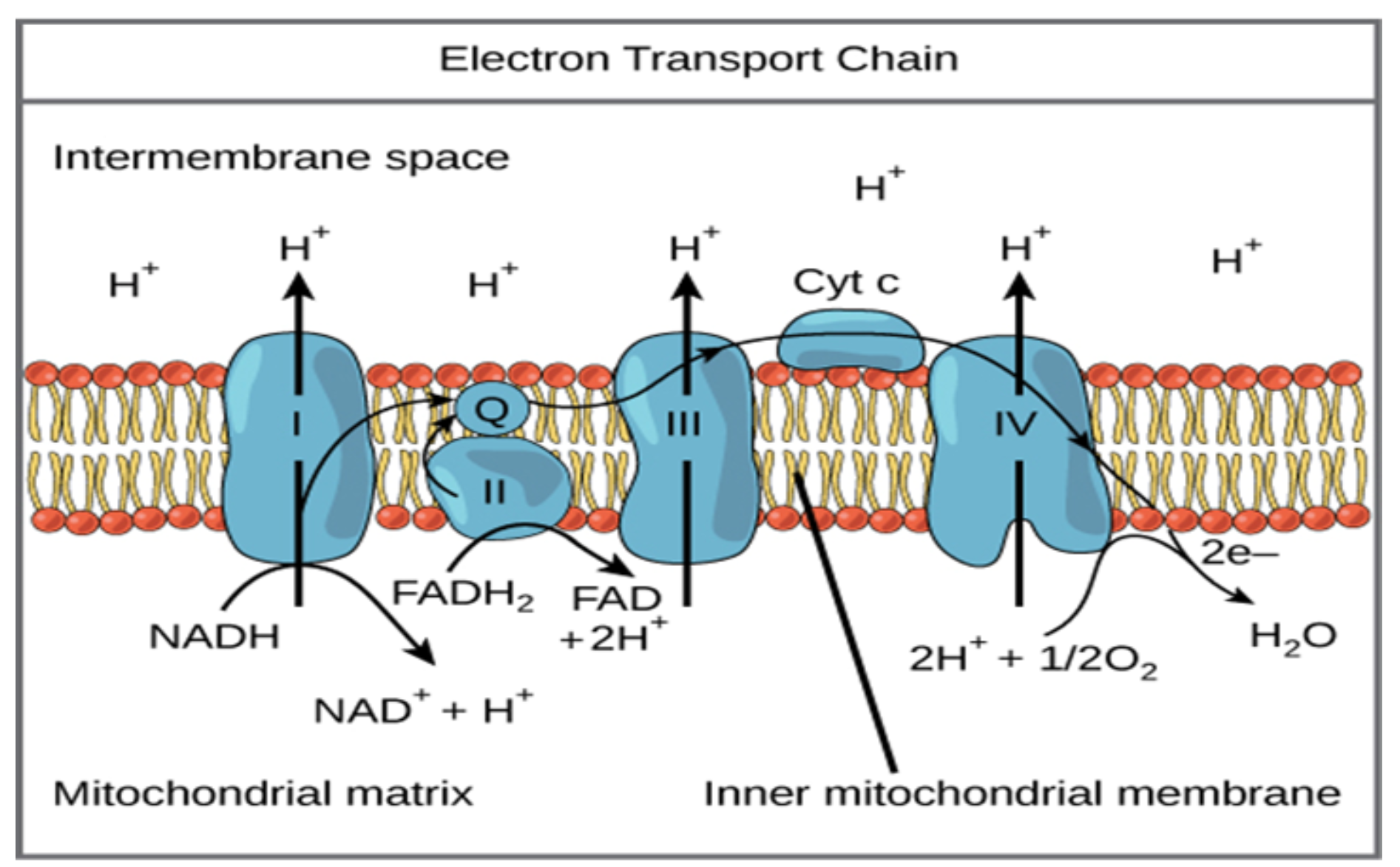
به طورویژه، من در مورد دستهبندی کلی فعالیتهای شیمیایی – هم به عنوان منبع محرک غیرتعادلی و هم به عنوان مکانیزم زیربنا برای خودسازماندهی- صحبت خواهم کرد. سلولها و ریززیستها انواع مختلف مواد شیمیایی را، از مواد مغذی گرفته تا مولکولهای سیگنالدهنده، تولید و مصرف میکنند. اتفاقی مشابه در مقیاس نانو در داخل خود سلولها اتفاق میافتد، جایی که آنزیمها تولید و مصرف مواد شیمیایی مورد نیاز برای زندگی را کاتالیز میکنند.
من دربارهٔ فرایندی کلی بحث قرار خواهم کرد که بهوسیلهٔ آن چنین ذرات فعال شیمیایی (اعم از سلولها یا آنزیمها یا کلوئیدهای مصنوعیِ مهندسیشده) میتوانند یکدیگر را «احساس» کنند و درنهایت، به روشهای مختلفی خودسازماندهی شوند.
یک ویژگی این فعل و انفعالات شیمیایی این است که تقارنِ کنش-واکنش را میشکنند؛ برای مثال، یک ذره ممکن است از ذرهٔ دوم دفع شود، که بدینترتیب جذب اولی میشود، به طوری که درنهایت آن را «تعقیب» میکند. این برهمکنشهای تعقیبکردن امکان تشکیل خوشههای بزرگی از ذرات را فراهم میکند که به طور مستقل «شنا» میکنند. در مورد آنزیمها، متوجه میشویم که آنها میتوانند خودبهخود در خوشههایی با ترکیب درست جمع شوند، به طوری که محصول یک آنزیم، بدون کمبود یا مازاد، به آنزیم بعدی در آبشار متابولیک منتقل شود. در نهایت، دربارهٔ این بحث خواهیم کرد که چگونه شکستن تقارن کنش-واکنش میتواند به یک سیستم – که دو میدان اسکالر توصیف میکنند- اجازه دهد تا شکست خودبهخودی تقارنهای انتقالی زمانی، معکوس زمانی، انتقال فضا و تقارنهای قطبی را نشان دهد.
سخنران: پروفسور رامین گلستانیان
موسسهٔ ماکس پلانک (مرکز تحقیقات دینامیک و خودسازماندهی) و دانشگاه آکسفورد

Title: How living matter self-organizes while breaking action-reaction symmetry
Speaker: Prof. Ramin Golestanian
Affiliation: Max Planck Institute for Dynamics and Self-Organization & Oxford University
Description:
There are many ways to study life, and one that is particularly appealing to physicists is regarding it as self-organized active soft matter that is away from equilibrium “just the right way’’. In this Colloquium, I will discuss this notion, and provide a number of examples of how we can begin to put together simple systems – from basic ingredients that we fully understand – that would exhibit the kind of active behaviour we find in living systems. In particular, I will discuss the general class of chemical activity both as the source of non-equilibrium drive and the underlying mechanism for self-organization. Cells and microorganisms produce and consume all sorts of chemicals, from nutrients to signalling molecules. The same happens at the nanoscale inside cells themselves, where enzymes catalyze the production and consumption of the chemicals needed for life. I will discuss a generic mechanism by which such chemically-active particles, be it cells or enzymes or engineered synthetic colloids, can “sense” each other and ultimately self-organize in a multitude of ways. A peculiarity of these chemical-mediated interactions is that they break action-reaction symmetry: for example, one particle may be repelled from a second particle, which is in turn attracted to the first one, so that it ends up “chasing” it. Such chasing interactions allow for the formation of large clusters of particles that “swim” autonomously. Regarding enzymes, we find that they can spontaneously aggregate into clusters with precisely the right composition, so that the product of one enzyme is passed on, without lack or excess, to the next enzyme in the metabolic cascade. Finally, I will discuss how breaking the action-reaction symmetry can allow a system described by two scalar fields to exhibit spontaneous breaking of time translation, time-reversal, space translation, and polar symmetries.
Date: Wednesday, May 25, 2022
6pm (Tehran)
Khordad 4, 1401
لینک شرکت در سخنرانی (بر روی گزینه میهمان کلیک کنید):
Skyroom (Click)