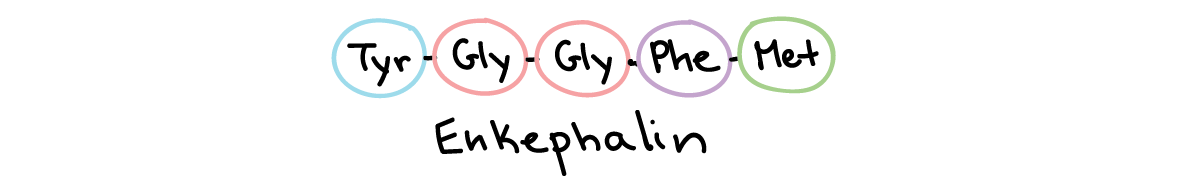انتقالدهندهها و گیرندههای عصبی
ترجمه: امین مخفی
آیا میدانید میلیاردها سلول عصبی و تریلیونها سیناپس در مغز شگفتانگیز شما وجود دارد؟
بیشتر سیناپسهای شما سیناپس شیمیاییاند؛ به این معنی که پیامرسانهای شیمیایی، اطلاعات را از یک نورون به نورون دیگر منتقل میکنند.
در این مقاله، به ناقلهای عصبی (پیامرسانهای شیمیاییِ ترشحشده از سلولهای عصبی) میپردازیم که میتوانند با سلولهای همسایه «صحبت کنند»؛ همچنین دربارۀ پروتئینهای گیرنده بحث میکنیم که به سلول هدف اجازه میدهند پیام را «بشنود».
ناقلهای عصبیِ متعارف و غیر متعارف (معمولی یا غیرمعمولی)
ناقلهای عصبی انواع مختلفی دارند (و البته هنوز هم ناقلهای جدیدی دارند کشف میشوند!)
فرضیهها دربارۀ آنچه باعث میشود یک ناقل عصبی ایجاد شود، در گذر زمان، تغییر و گسترش یافته است؛ بنابراین برخی از ناقلهای عصبی که اخیراً کشف شدهاند ممکن است با در نظرگرفتنِ تعاریف قدیمیتر «غیرمعمول» یا «غیرمتعارف» باشند.
ناقلهای عصبی متعارف
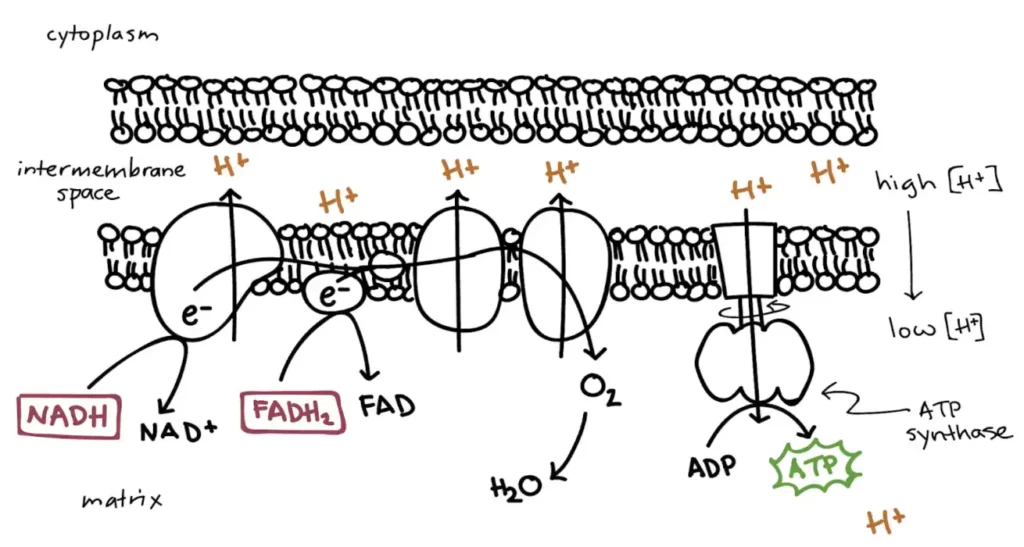
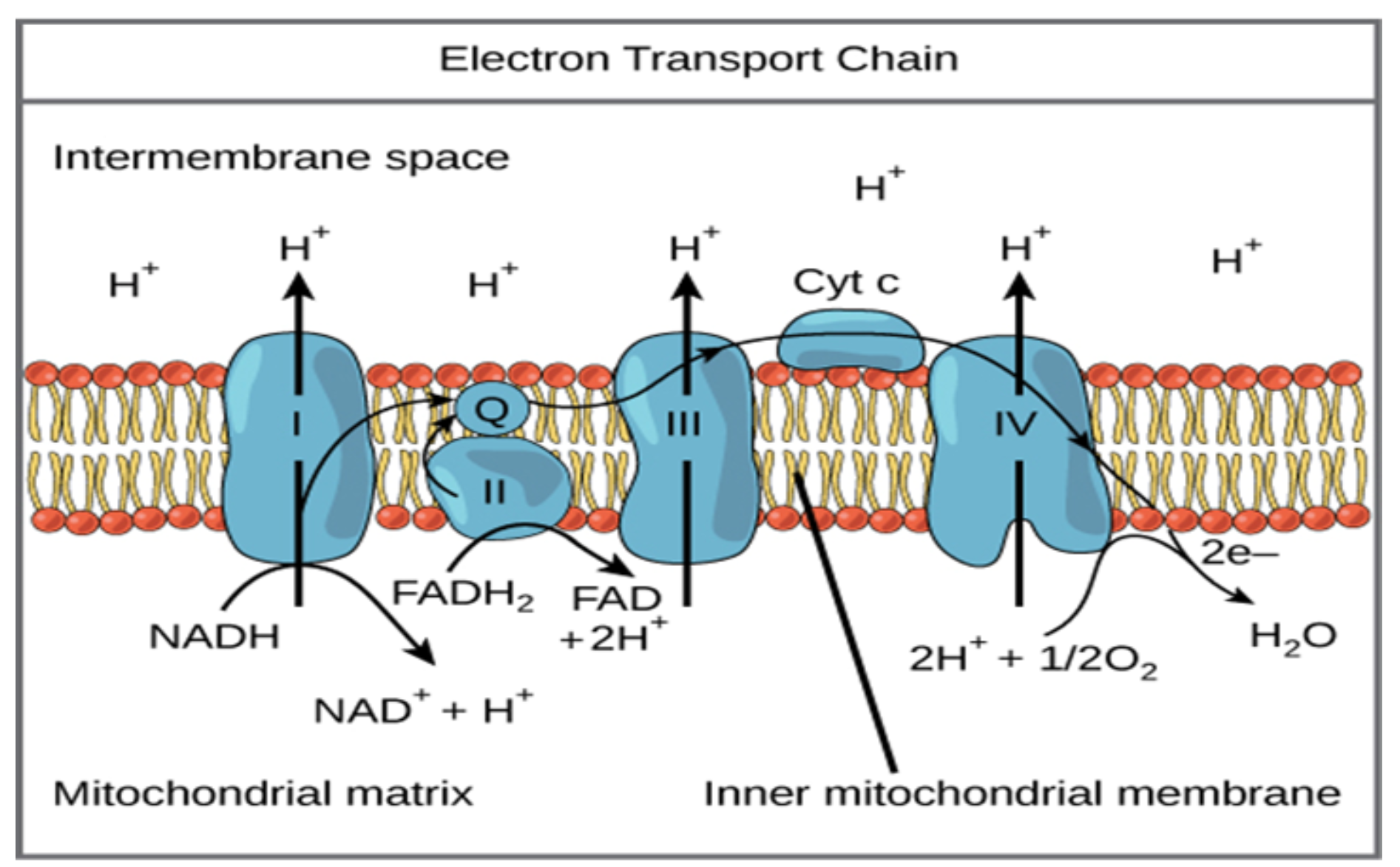
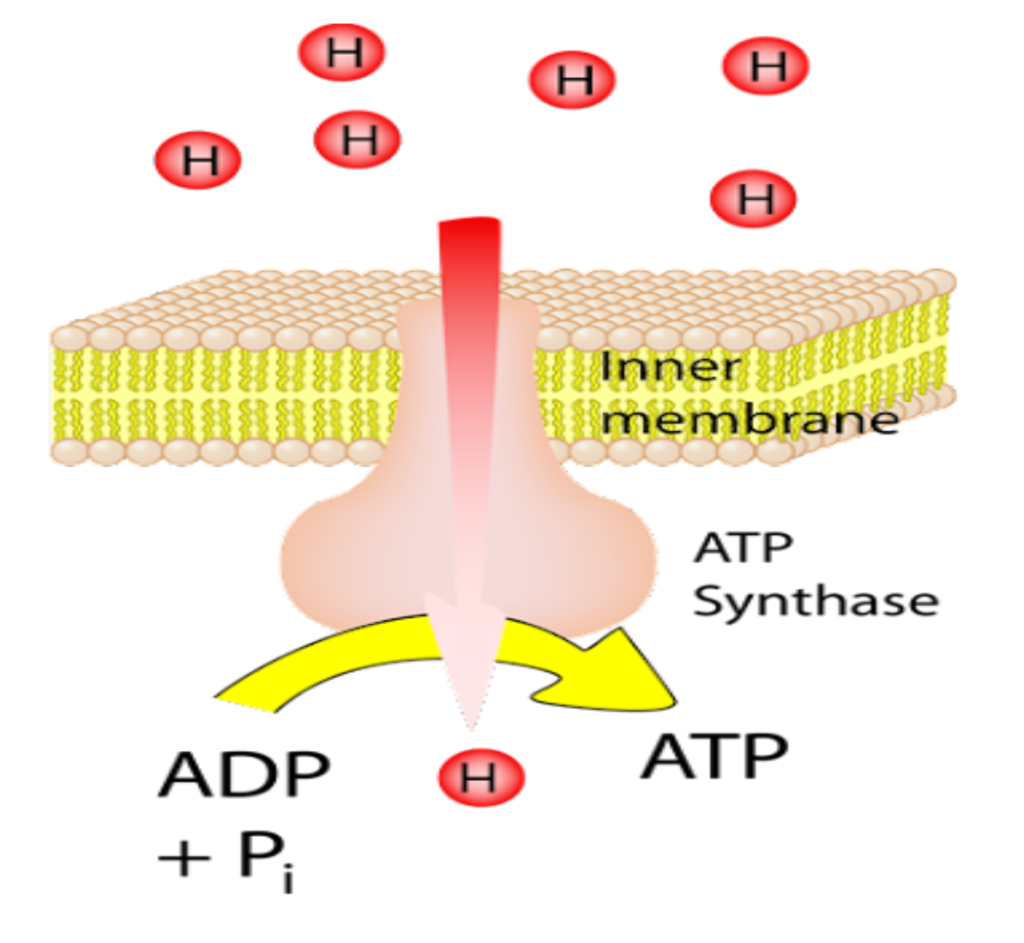
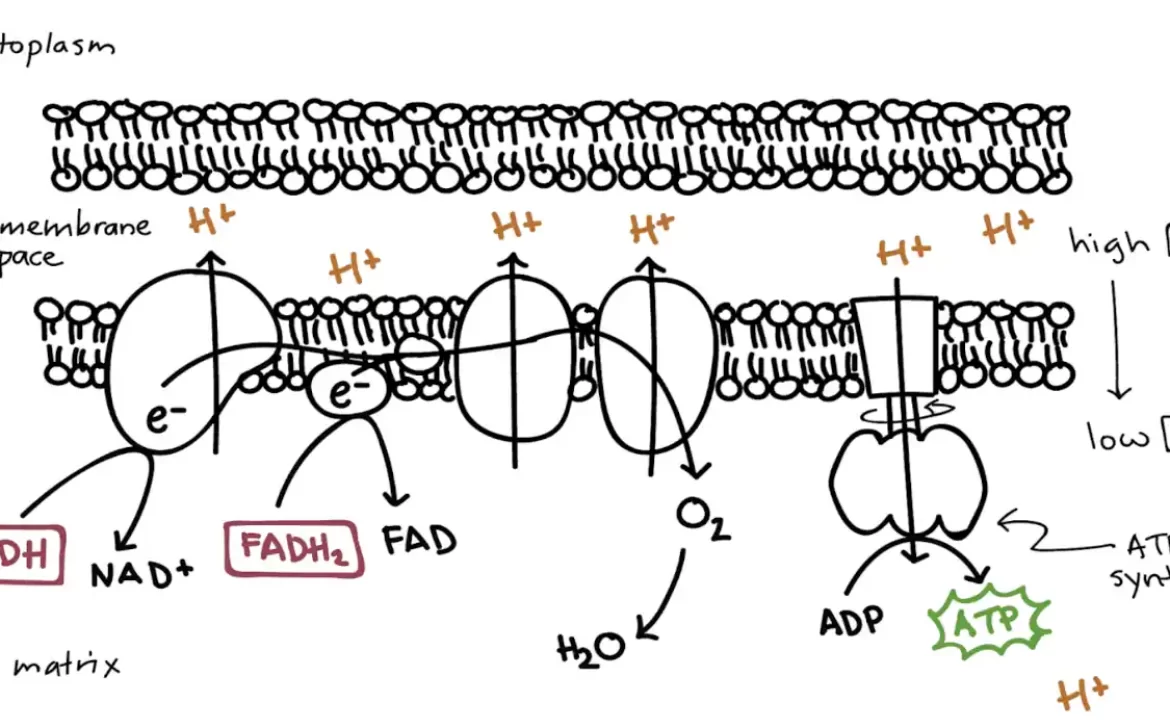
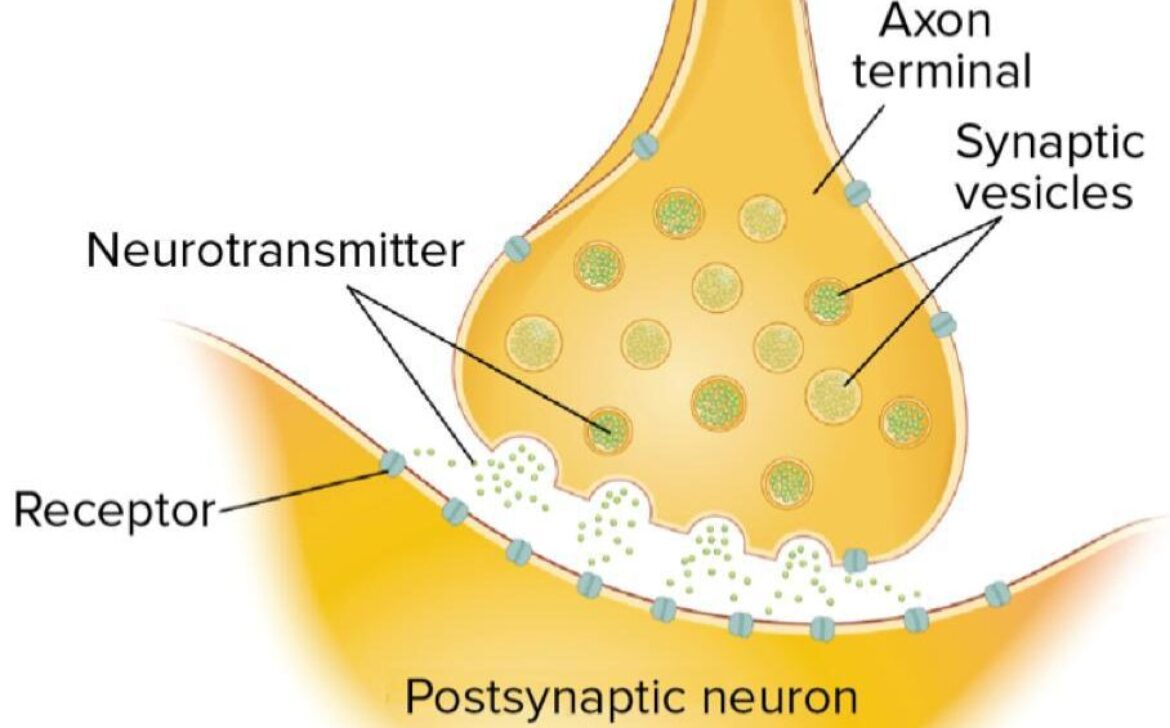
پیامرسانهای شیمیایی که به عنوان ناقلهای عصبی متعارف عمل میکنند ویژگیهایی اساسی دارند. آنها در وزیکولهای سیناپسی ذخیره میشوند، وقتی +Ca2 در پاسخ به یک پتانسیل عمل وارد پایانۀ آکسونی میشود، آزاد میشوند و با اتصال به گیرندههای غشای سلول پسسیناپسی عمل میکنند.

تصویر سیناپس و ناقلهای عصبی ذخیرهشده در وزیکولهای سیناپسیِ درون پایانۀ آکسونی؛
در پاسخ به یک پتانسیل عمل، وزیکولها با غشای پیشسیناپسی جوش میخورند و ناقل عصبی را در شکاف سیناپسی آزاد میکنند.
ناقلهای عصبی متعارف را میتوان به دو گروه اصلی تقسیم کرد: مولکول کوچک ناقل و نوروپپتیدها (نوعی پروتئین کوچک).
مولکولهای کوچک ناقل
مولکولهای کوچکِ ناقل مولکولهای آلیِ کوچک هستند که انواع مختلفی دارند:
- ناقلهای عصبی آمینو اسید: گلوتامات، GABA (اسید -γآمینوبوتیریک) و گلایسین. همۀ اینها اسیدهای آمینه هستند، اگرچه GABA اسید آمینهای نیست که در پروتئینها یافت شود.
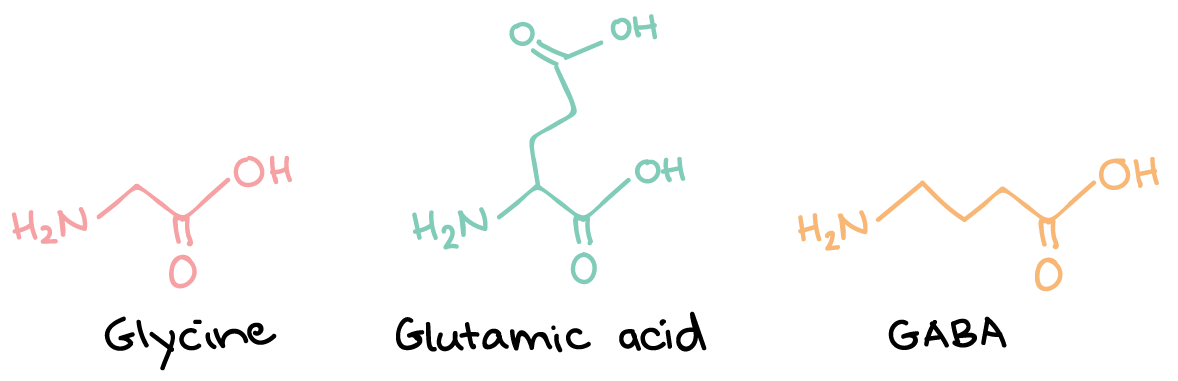
ساختارهای گلایسین، اسید گلوتامیک وGABA همگی اسیدهای آمینه هستند.
- آمینهای بیوژنیک: دوپامین، نوراپینفرین، اپینفرین، سروتونین و هیستامین که از پیشسازهای آمینو اسید ساخته میشوند.
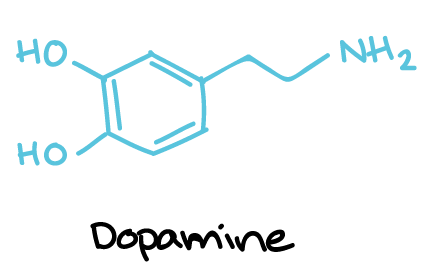
ساختار دوپامین
- ناقلهای عصبی پورینرژیک: ATP و آدنوزین که نوکلئوتیدها و نوکلئوزیدها هستند.
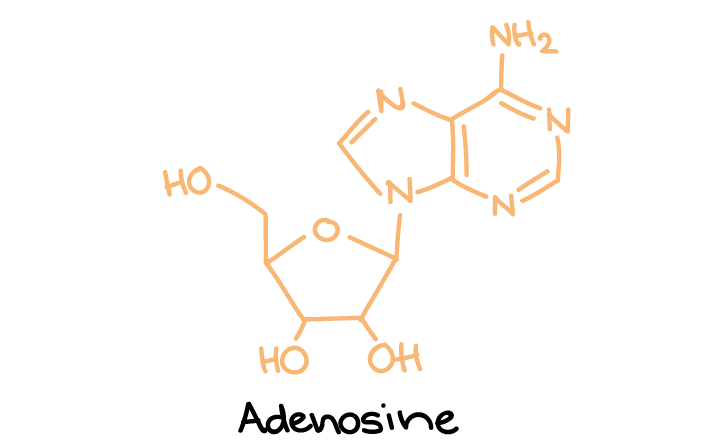
ساختار آدنوزین
- استیلکولین، که در هیچ یک از دستههای ساختاری دیگر قرار نمیگیرد، اما یک ناقل عصبی اصلی در اتصالات عصبی عضلانی است (جایی که اعصاب به عضلات متصل میشوند) و همچنین سیناپسهای خاص دیگر.
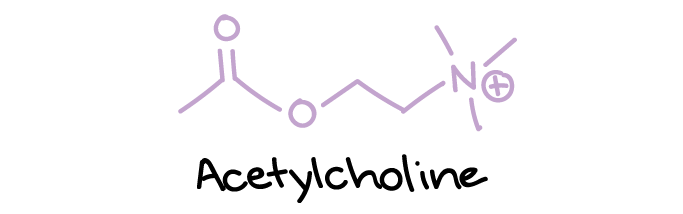
ساختار استیل کولین
نوروپپتیدها
نوروپپتیدها هر کدام از سه آمینو اسید یا بیشتر تشکیل شدهاند و بزرگتر از مولکولهای کوچک ناقل هستند. تعداد زیادی نوروپپتید متفاوت وجود دارد: برخی از آنها شامل اندورفین و انکفالین هستند که از درد جلوگیری میکنند، ماده P که حامل سیگنالهای درد است و نوروپپتید Y که باعث تحریک غذا خوردن میشود و ممکن است برای جلوگیری از تشنج عمل کند.
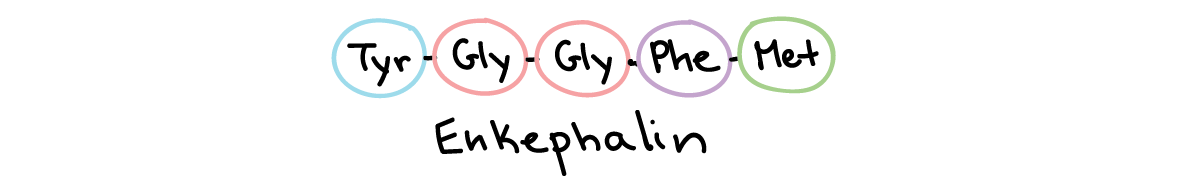
توالی اسیدهای آمینۀ انکفالین
اثرات ناقل عصبی به گیرندۀ آن بستگی دارد. بعضی از ناقلهای عصبی «تحریککننده» تلقی میشوند و باعث میشوند در نورونِ هدف پتانسیل عمل ایجاد شود. برخی دیگر، بهطورکلی، «مهارکننده (بازدارنده)» تلقی میشوند و باعث میشوند که احتمال ایجاد پتانسیل عمل کمتر شود؛ مثلاً گلوتامات عاملِ اصلیِ انتقالدهندۀ تحریککننده در سیستم عصبی مرکزی است. GABA اصلیترین ناقل عصبی مهارکننده در مغز مهرهداران بزرگسال است. گلایسین اصلیترین ناقل عصبی بازدارنده در نخاع است.
بااینحال، «تحریککننده» و «مهارکننده» واقعاً مشخصههای صریح و شفافی نیستند که بتوانیم بر اساس آن ناقلهای عصبی را مرتب کنیم. در عوض، یک ناقل عصبی، بسته به زمینه، گاهی اوقات میتواند اثر تحریککنندگی یا مهارکنندگی داشته باشد.
چگونه میتواند چنین باشد؟ همانطور که مشخص شد، برای هر ناقل عصبی فقط یک نوع گیرنده وجود ندارد. در عوض، یک ناقل عصبی معین معمولاً میتواند به چندین گیرندۀ پروتئینی مختلف متصل گردد و آنها را فعال کند. اینکه اثرِ یک ناقلِ عصبیِ خاص، در یک سیناپس معین، تحریککنندگی باشد یا مهار کنندگی، به این بستگی دارد که کدام یک از گیرندههای آن بر روی سلول پسسیناپسی (سلول هدف) وجود داشته باشد.
مثالِ استیل کولین
ناقل عصبی استیل کولین در محلِ اتصالِ عصبی-ماهیچهای در ماهیچۀ اسکلتی تحریککننده است و باعث انقباض ماهیچه میشود. در مقابل، در قلب مهارکننده است و ضربان قلب را کند میکند. این اثرات مختلف امکانپذیر است، زیرا دو نوع پروتئینِ گیرندۀ مختلفِ استیل کولین در دو مکان یافت میشود.
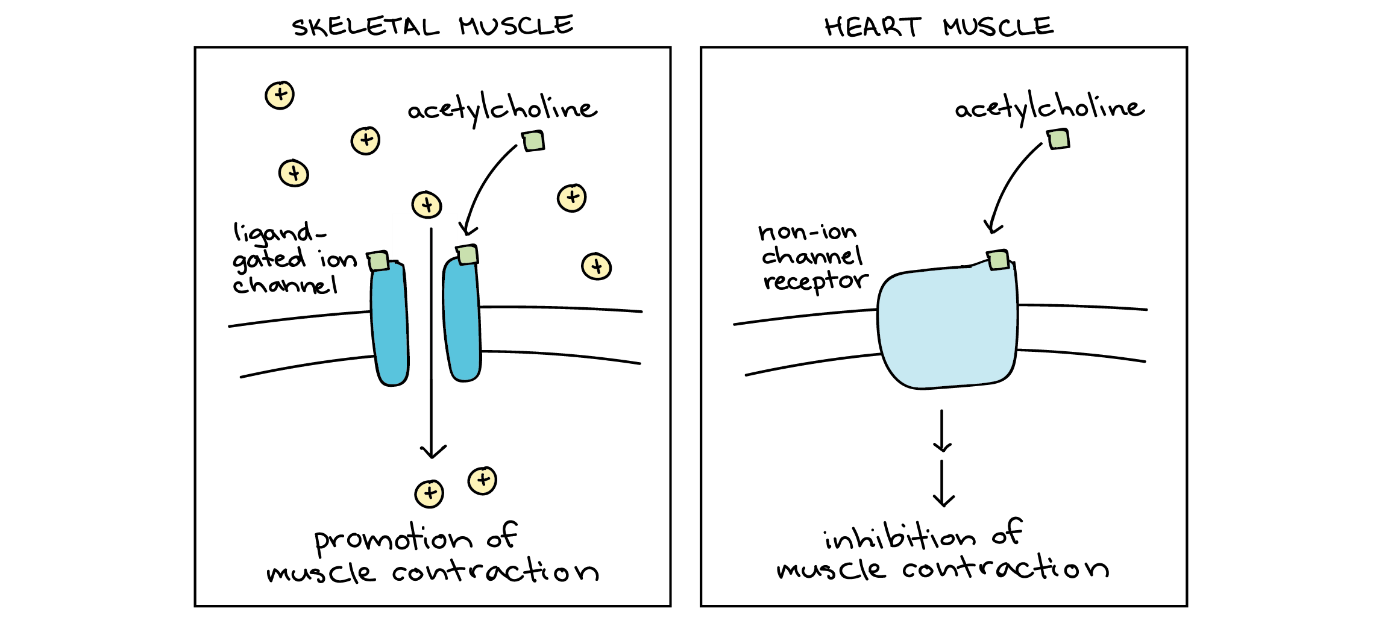
ویژگی نوع سلول در پاسخ به استیلکولین
شکل سمت چپ: سلول ماهیچهای اسکلتی. مولکول استیلکولین به یک کانال یونی دریچهدار، وابسته به لیگاند، متصل میشود و باعث باز شدن آن میشود و اجازه میدهد یونهای مثبت وارد سلول شوند. این رویداد باعث انقباض ماهیچه میشود.
شکل سمت راست: سلول ماهیچهای قلب. مولکول استیلکولین به یک گیرندۀ متصل به پروتئین G متصل میشود و یک پاسخ ضعیف را ایجاد میکند که منجر به مهار انقباض ماهیچه میشود.
- به گیرندههای استیلکولین در سلولهای ماهیچهای اسکلتی گیرندههای استیلکولین نیکوتینی گفته میشود. آنها کانالهای یونی هستند که در پاسخ به اتصال استیلکولین باز میشوند و باعث دپولاریزاسیونِ سلول هدف میشوند.
- به گیرندههای استیلکولین در سلولهای ماهیچهای قلب گیرندههای استیلکولین موسکارینی گفته میشود. آنها کانالهای یونی نیستند، اما باعث ایجاد مسیرهای پیامرسانی در سلول هدف میشوند که از بهوجودآمدنِ پتانسیل عمل جلوگیری میکنند.
انواع گیرندههای ناقل عصبی
همانطور که مثال فوق نشان میدهد، ما میتوانیم پروتئینهای گیرنده را ─که ناقلهای عصبی فعال کردهاند─ به دو گروه گسترده تقسیم کنیم:
- کانالهای یونی وابسته به لیگاند: این گیرندهها پروتئینهای کانال یونی پوشانندۀ غشایی هستند که مستقیماً در پاسخ به اتصال لیگاند باز میشوند.
- گیرندههای متابوتروپیک: این گیرندهها خود کانالهای یونی نیستند. اتصال ناقل عصبی یک مسیر پیامرسانی را ایجاد میکند که ممکن است بهطور غیرمستقیم کانالها را باز یا بسته کند (یا کاملاً اثر دیگری داشته باشد).
کانالهای یونی وابسته به لیگاند
اولین گروهِ گیرندههای ناقل عصبی کانالهای یونی وابسته به لیگاند هستند که به آنها گیرندههای یونوتروپیک نیز گفته میشود. هنگام اتصال ناقل عصبی، آنها دچار تغییر شکل میشوند و باعث بازشدن کانال میشوند. این بسته به یونهایی است که میتوانند از کانال عبور کنند و غلظت آنها در داخل و خارج سلول ممکن است اثری تحریککننده یا مهارکننده داشته باشد.
کانالهای یونیِ وابسته به لیگاند، مجموعههای پروتئینی بزرگی هستند. آنها قسمتهای خاصی دارند که این قسمتها اتصالدهندۀ ناقل عصبی و همچنین بخشهای پوشانندۀ غشایی هستند که کانال را تشکیل میدهد.
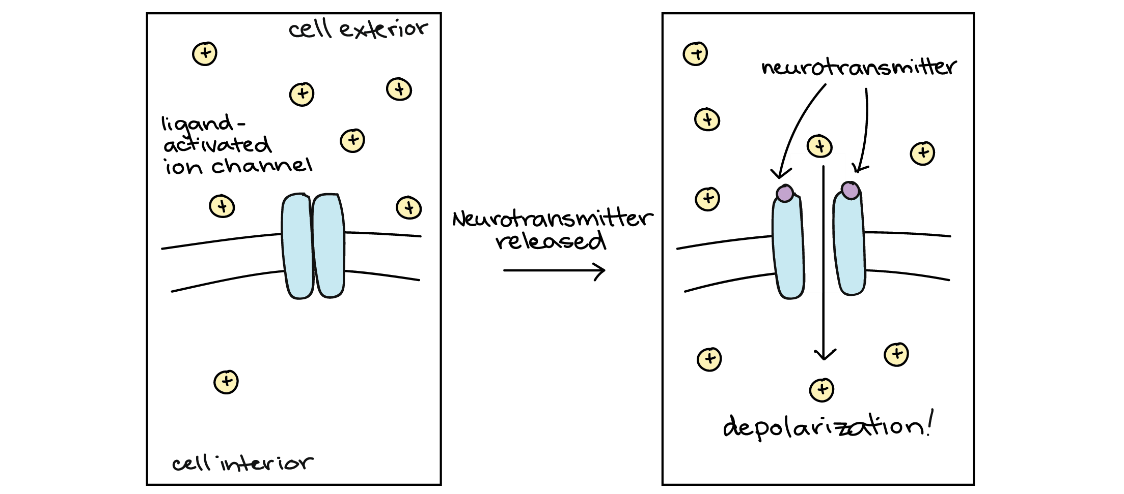
تصویرِ کانال وابسته به لیگاند
هنگامی که ناقل عصبی به کانال متصل میشود، باز میشود و بارهای مثبت از سطح شیب غلظت خود پایین میروند و به سلول وارد و باعث دپولاریزاسیون میشوند.
کانالهای یونی وابسته به لیگاند معمولاً پاسخهای فیزیولوژیکی بسیار سریعی ایجاد میکنند. جریان شروع به حرکت میکند (یونها شروع به عبور از غشا میکنند). در دهها میکروثانیه اتصال ناقل عصبی انجام و جریان متوقف میشود (درصورتی که ناقل عصبی دیگر به گیرندههای خود متصل نباشد). در بیشتر موارد، ناقل عصبی، بهسبب آنزیمهایی که آن را تجزیه میکنند یا سلولهای همسایه که آن را جذب میکنند، به سرعت از سیناپس خارج میشود.
گیرندههای متابوتروپیک
فعالسازی گیرندههای ناقل عصبیِ گروه دوم فقط بهطور غیرمستقیم بر باز و بسته شدن کانال یونی تأثیر میگذارد. در این حالت، پروتئینی که ناقل عصبی به آن متصل میشود (گیرندۀ ناقل عصبی)، یک کانال یونی نیست. پیامرسانی از طریق این گیرندههای متابوتروپیک به فعالشدن چندین مولکول در داخل سلول بستگی دارد و اغلب شامل یک مسیر پیامرسان دوم (a second messenger pathway) است، اما از آنجا که مراحل بیشتری را شامل میشود، پیامرسانی از طریق گیرندههای متابوتروپیک بسیار کندتر از پیامرسانی از طریق کانالهای یونی وابسته به لیگاند است.
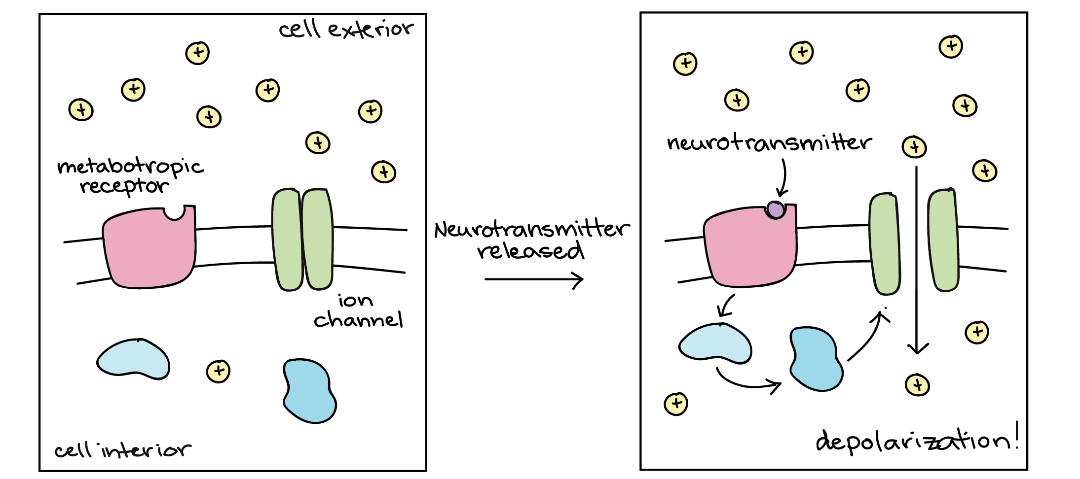
گیرنده های متابوتروپیک
برخی از گیرندههای متابوتروپیک، هنگامی که فعال میشوند، اثرات تحریکی دارند (باعث انجام پتانسیل عمل در سلول میشوند)، در حالیکه برخی دیگر اثرات مهاری دارند. بیشترِ اوقات، این تأثیرات به این دلیل رخ میدهد که گیرندۀ متابوتروپیک، یک مسیر پیامرسانی را راهاندازی میکند که یک کانال یونی را باز یا بسته میکند. ازطرفدیگر، ناقل عصبیای که به گیرندۀ متابوتروپیک متصل میشود، ممکن است با نحوۀ پاسخ سلول به ناقل عصبی دیگر ─که از طریق یک کانالِ لیگاند عمل میکند─ متفاوت باشد. همچنین، پیامرسانی از طریق گیرندههای متابوتروپیک، میتواند بر روی سلول پسسیناپسی تأثیر بگذارد بهطوری که اصلاً کانالهای یونی را درگیر نکند.
انتقالدهندههای عصبی متعارف و انواع گیرندههای آنها
| ناقل عصبی |
گیرندۀ وابسته به لیگاند |
گیرندۀ متابوتروپیک |
| آمینو اسیدها |
|
|
| GABA |
دارد (مهارکننده) |
دارد |
| گلوتامات |
دارد (تحریککننده) |
دارد |
| گلیسین |
دارد (مهارکننده) |
|
| آمینهای بیوژنیک |
|
|
| دوپامین |
|
دارد |
| نوراپینفرین |
|
دارد |
| اپینفرین |
|
دارد |
| سروتونین |
دارد (تحریککننده) |
دارد |
| هیستامین |
|
دارد |
| پورینرژیک |
|
|
| آدنوزین |
|
دارد |
| ATP |
دارد (تحریککننده) |
دارد |
| استیل کولین |
دارد (تحریککننده) |
دارد |
| نوروپپتیدها (اکثر آنها) |
|
دارد |
این جدول یک فهرست جامع نیست، اما برخی از معروفترین ناقلهای عصبی معمولی را پوشش میدهد.
ناقلهای عصبی غیرمتعارف
همۀ ناقلهای عصبی، که تاکنون دربارۀ آنها بحث کردهایم، میتوانند ناقلهای عصبی معمولی باشند. اخیراً، چندین گروه از ناقلهای عصبی شناسایی شدهاند که از همه قوانین معمول پیروی نمیکنند. اینها ناقلهای عصبی غیرمتعارف یا غیرمعمول در نظر گرفته میشوند.
دو گروه از فرستندههای (پیکهای) غیرمتعارف، اندوکانابینوئیدها و انتقالدهندههای گازی (گازهای ناقل: گازهای محلول مانند نیتریک اکسید NO و کربن مونوکسید CO) هستند. این مولکولها از این جهت که در وزیکول سیناپسی ذخیره نمیشوند غیرمتعارف هستند و ممکن است پیامهایی را از نورون پسسیناپسی به نورون پیشسیناپسی منتقل کنند. همچنین، انتقالدهندههای گازی میتوانند به جای تعامل با گیرندههای موجود در غشایِ پلاسماییِ سلولهایِ هدفِ خود، از غشای سلول عبور کنند و مستقیماً بر روی مولکولهای داخل سلول عمل کنند.
با یادگیریِ بیشترِ نحوۀ کار سلولهای عصبی، احتمالاً، پیامرسانهای غیرمتعارف دیگری کشف میشوند. با کشف این پیامرسانهای شیمیایی جدید، ممکن است مجبور شویم فرضیهها و ذهنیت خود را در مورد معنای ناقل عصبی تا حد زیادی تغییر دهیم.
منبع:
https://www.khanacademy.org/science/biology/human-biology/neuron-nervous-system/a/neurotransmitters-their-receptors
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
link toto togel
toto togel
jacktoto
situs toto
situs toto
situs toto
jacktoto
situs toto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
situs togel
jacktoto
jacktoto
jacktoto
toto slot
situs toto
situs toto
jacktoto
situs toto
situs togel
situs togel
situs togel
jacktoto
jacktoto
jacktoto
situs toto
slot online
jacktoto
toto togel
situs toto
situs togel
jacktoto
jacktoto
toto slot
situs toto
link toto togel
situs slot
toto togel
jacktoto
jacktoto
situs toto
link toto
toto togel
toto togel
jacktoto
togel online
toto togel
toto togel
situs toto
jacktoto
situs toto
jacktoto
situs toto
situs toto
jacktoto
situs slot
situs toto
situs toto
slot gacor
jacktoto
jacktoto
slot online
jacktoto
situs toto
link slot
link slot
jacktoto
situs toto
situs slot
toto togel
jacktoto
link togel
jacktoto
link slot
jacktoto
toto slot
toto togel
link slot
situs slot
link togel
jacktoto
situs toto
toto togel
jacktoto
slot resmi
situs slot
jacktoto
link slot
toto slot
situs togel
jacktoto
link slot
toto slot
toto togel
toto togel
situs toto
toto slot
jacktoto
situs slot
jacktoto
jacktoto
situs gacor
link slot
jacktoto
slot resmi
situs toto
jacktoto
toto togel
toto togel
toto togel
situs toto
jacktoto
jacktoto
toto slot
toto togel
link slot gacor
situs toto
toto togel
situs toto
toto togel
situs toto
jacktoto
jacktoto
slot resmi
jacktoto
toto togel
situs toto
jacktoto
toto slot
situs toto
toto slot
situs toto
jacktoto
jacktoto
jacktoto
jacktoto
situs togel
situs togel
situs togel
situs toto
situs togel
toto togel
jacktoto
jacktoto
jacktoto
jacktoto
toto togel
jacktoto
toto
situs toto
jacktoto
jacktoto
toto slot
jacktoto
situs slot
jacktoto
toto slot
jacktoto
toto slot
situs toto
link slot gacor
jacktoto
jacktoto
jacktoto
situs toto
toto togel
toto slot
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
situs togel
jacktoto
jacktoto
jacktoto
jacktoto
rtp slot
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
toto togel
slot online
situs toto
toto togel
slot gacor
toto togel
situs toto
jacktoto
jacktoto
situs toto
jacktoto
toto slot
situs toto
situs togel
toto togel
situs toto
toto togel
jacktoto
link slot gacor
jacktoto
situs toto
jacktoto
slot gacor
toto togel
situs toto
link togel
jacktoto
situs toto
link slot
toto togel
situs toto
situs toto
situs toto
situs toto
situs toto
situs toto
situs toto
situs toto
situs toto
situs togel
jacktoto
jacktoto
jacktoto
jacktoto
link togel
jacktoto
link slot
situs toto
link slot
jacktoto
link slot
jacktoto
jacktoto
jacktoto
toto togel
jacktoto
jacktoto
jacktoto
situs slot
jacktoto
jacktoto
link slot
slot gacor
situs toto
situs toto
jacktoto
toto slot
toto slot
jacktoto
link togel
jacktoto
link slot
toto slot
jacktoto
jacktoto
jacktoto
situs resmi
situs slot
situs slot
jacktoto
slot 4d
jacktoto
jacktoto
jacktoto
jacktoto
situs toto
jacktoto
jacktoto
togel
situs toto
toto togel
link slot
link slot
toto slot
jacktoto
jacktoto
slot resmi
situs slot
toto togel
toto togel
toto togel
jacktoto
slot gacor
slot
jacktoto
jacktoto
situs toto
jacktoto
toto slot
situs togel
situs slot
situs toto macau
situs toto
slot gacor
jacktoto
toto togel
togel
jacktoto
jacktoto
jacktoto
slot online
jacktoto
toto slot
situs toto togel
situs toto
situs toto
slot gacor
slot online
situs toto
jacktoto
toto togel
link slot
toto slot
link togel
situs toto
situs toto
situs toto
situs toto
jacktoto
jacktoto
togel
jacktoto
akfar indah
slot resmi
situs toto
jacktoto
toto
toto togel
bandar togel
toto togel
link togel
togel
situs toto
toto togel
jacktoto
jacktoto
jacktoto
toto togel
slot resmi
jacktoto
jacktoto
link slot
link togel
jacktoto
link togel
jacktoto
situs toto
jacktoto
jacktoto
situs toto
jacktoto
jacktoto
kawi898
kawi898
kawi898
situs toto
jacktoto
jacktoto
link togel
kawi898
toto macau
kawi898
situs slot
situs slot
kawi898
situs slot
jacktoto
toto togel
toto togel
jacktoto
situs slot
kawi898
jacktoto
bandar togel
situs togel
jacktoto
jacktoto
toto
kawi898
toto togel
jacktoto
link slot
link macau
situs slot
jacktoto
link slot
toto togel
situs slot
slot resmi
toto slot
situs gacor
situs togel
situs toto
jacktoto
situs togel
situs toto
toto togel
slot resmi
link slot
toto togel
jacktoto
kawi898
link slot gacor
jacktoto
jacktoto
situs slot
link slot
link togel
situs togel resmi
bandar togel
situs slot online
situs togel resmi
jacktoto
slot gacor
slot
situs toto
akte koto banda aceh
situs slot
situs togel tepercaya
rtp slot
toto togel
jacktoto
situs toto
situs toto
situs slot
link toto macau
situs toto
link toto togel
situs toto togel
slot online
toto togel
link slot
slot
situs toto
toto togel
togel resmi
togel resmi
situs toto
toto togel
jacktoto
slot online
slot 4d
toto slot
situs slot online
link togel
jacktoto
situs gacor
situs slot resmi
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
jacktoto
situs slot
jacktoto
jacktoto
jacktoto
toto togel
link slot
toto togel
slot gacor
situs togel
jacktoto
situs togel
toto slot
situs togel
situs toto togel
kawi898
jacktoto
situs slot
jacktoto
jacktoto
jacktoto
toto slot
link togel
situs toto
link slot
situs togel
jacktoto
jacktoto
slot gacor
situs toto
toto togel
situs toto togel
togel resmi
jacktoto
jacktoto
situs togel
jacktoto
jacktoto
jacktoto
toto slot
toto slot
link togel
situs toto
toto slot
situs slot online
situs toto
situs toto togel
toto togel
kawi898
jacktoto
situs gacor
toto
situs toto
jacktoto
jacktoto
situs gacor
slot online
jacktoto
situs gacor
togel resmi
situs togel
slot gacor
toto togel
jacktoto
situs toto togel
situs toto
jacktoto
situs toto
slot gacor
toto
jacktoto
situs slot
situs slot
toto slot
kawi898
slot resmi
situs slot
link slot
slot resmi
situs togel
toto togel
link togel 4d
link slot
toto slot
togel resmi
jacktoto
situs slot
toto
situs slot
togel
link slot
situs gacor
jacktoto
togel 4d
jacktoto
toto togel
toto slot
pendidikan farmasi
jacktoto
kawijitu
kawijitu
kawijitu
kawijitu
link slot