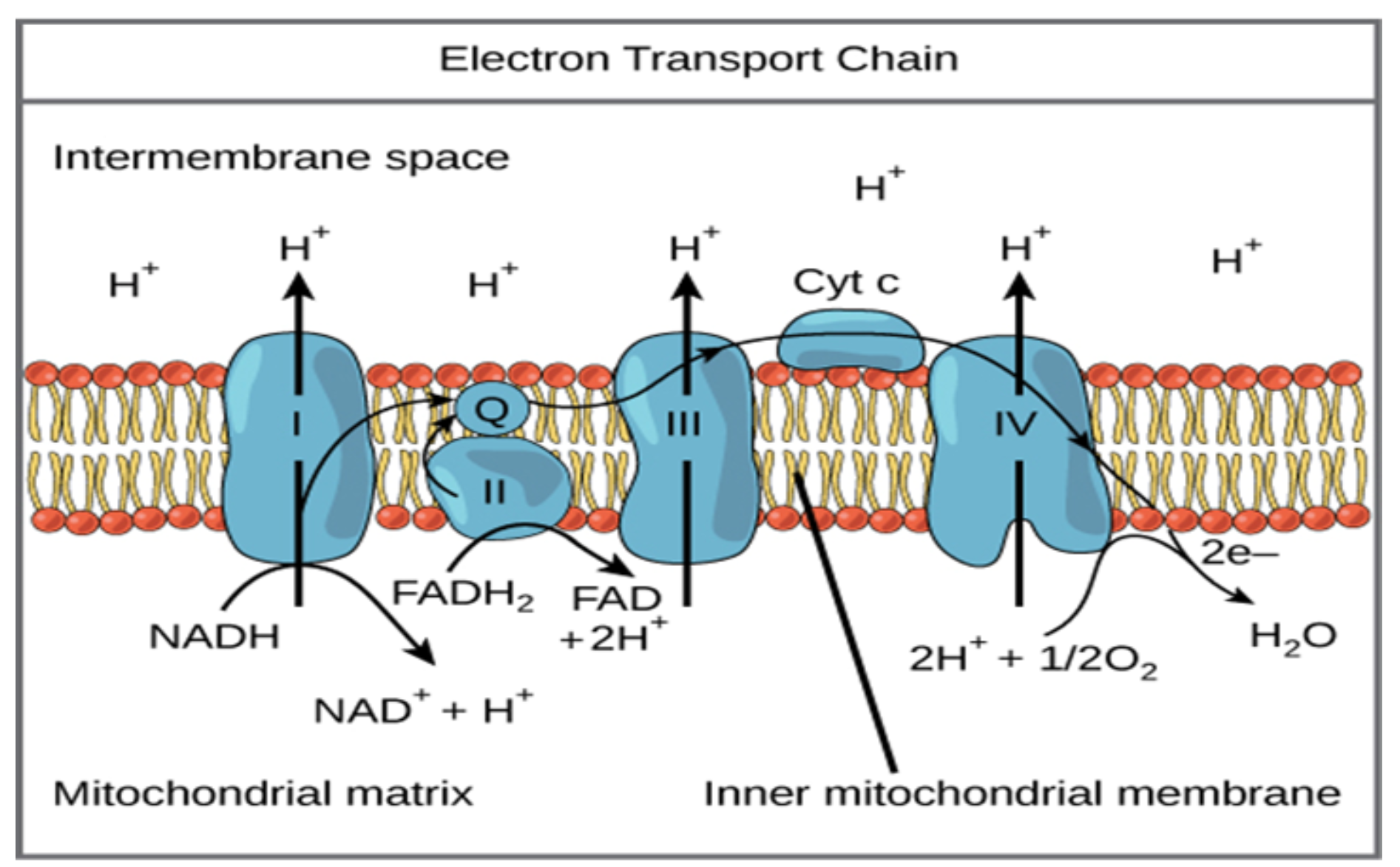
بومشناسی بیماری از دیدگاههای فیزیکی
عنوان سخنرانی: بومشناسی بیماری از دیدگاههای فیزیکی
چکیده:
من در این سخنرانی کارهای اخیر خود را دربارهٔ مدلسازی دینامیکهای واگیر متقابل، به عنوان مثال دینامیکهای SIR یا SIS جفتشده، در تقریبهای میدانهای متوسط و همچنین روی شبکههای پیچیدهٔ تصادفی یا تجربی مرور خواهم کرد. همچنین در مورد این بحث خواهم کرد و نشان خواهم داد که چگونه نتایج اخیر ما، درک و پیشبینیمان از دینامیک اپیدمی و اکولوژی بیماریها را بهبود میبخشد و در عین حال چالشهای جدیدی را در فیزیک پدیدههای حیاتی ایجاد میکند. همچنین به طور مختصر دربارهٔ بیماری SARS-COV-2 از دیدگاه اکولوژی بیماری بحث خواهم کرد و مطالعات اخیر خود را دربارهٔ «پاسخهای رفتاری به گسترش SARS-COV-2 » ارائه خواهم داد. این مطالعات بر تحلیل و مدلسازی دادههای تجربی از جمله استراتژیهای آزمایش، ترافیک هوایی، تحرکپذیری شهری، نابرابری (فاصله طبقاتی اقتصادی–اجتماعی)، انتشار اخبار و غیره (در ایران یا آمریکا یا سطح جهانی) تمرکز دارد.
فاخته قنبرنژاد از دانشکدهٔ فیزیک دانشگاه صنعتی شریف در این زمینه در وبینار فیزیک سخنرانی خواهد کرد.

ویدیوی این سخنرانی پس از برگزاری در همین صفحه قرار خواهد گرفت.
Title: Disease Ecology From Perspectives of Physics
Speaker: Fakhteh Ghanbarnejad
Affiliation: Physcics Department of Sharif University of Technology
Description:
Here I will review my recent works on modelling interacting contagious dynamics, for example coupled SIR or SIS dynamics, in mean field approximations and also on different random generated or empirical complex networks. I show and discuss how our recent results have been improving our understanding and prediction of epidemic dynamics and disease ecology while raising new questions and challenges in physics of critical phenomena. Also I will briefly discuss SARS-COV-2 from the perspective of disease ecology and present my recent studies on “behavioral responses to the COVID-19 spread”; which focus on the analysis and modelling of empirical data including testing strategies, air traffic, urban mobility, inequality (socio-economic classes), news spread, etc. in Iran or USA or globally.
Date: Wednesday, June 29th, 2022
6pm (Tehran)
Tir 8, 1401
لینک شرکت در سخنرانی (بر روی گزینه میهمان کلیک کنید):
Skyroom (Click)